Les effets biologiques du rayonnement
par Roger BELBÉOCH
Physicien, Université de Paris-sud
Résumé
Les effets biologiques du rayonnement: Les principaux effets
connus du rayonnement sur la santé sont sommairement présentés,
les effets aigus des doses fortes, les effets différés
et les effets de morbidité. Ces derniers ont jusqu'à
présent été négligés dans l'évaluation
du détriment causé par le rayonnement. Les observations
faites depuis la catastrophe de Tchernobyl parmi la population
vivant sur les territoires contaminés d'Ukraine et de Biélorussie
montrent que les effets de morbidité sont loin d'être
négligeables. En ce qui concerne les effets cancérigènes
(différés) du rayonnement, nous présentons
un résumé des derniers résultats obtenus
dans l'étude du suivi des survivants Japonais des bombardements
atomiques de 1945 ainsi que les conséquences qui en découlent
sur l'estimation du facteur de risque.
GÉNÉRALITÉS
I. Les effets aigus des fortes doses
Pour les fortes doses la gravité
des effets sur la santé dépend directement de la
dose reçue et assez peu des individus irradiés.
Il existe pour chaque type d'effets (nausée, troubles hématologiques,
signes neurologiques, affections intestinales, atteintes médullaires,
mort) un seuil en-dessous duquel il n'apparaît pas. Ces
effets sont dits non stochastiques car ils suivent des lois assez
strictes de causalité (déterministes).
L'expérience acquise sur les personnes
qui sont intervenues très près du réacteur
en détresse lors de la catastrophe de Tchernobyl et qui
ont été fortement irradiées montre que dans
ces cas il n'y a guère d'espoir d'éviter la mort.
La conclusion des experts soviétiques dans leur rapport
d'août 1986 à la conférence de Vienne est
très pessimiste [1]:
«Dans les accidents de rayonnement,
la proportion de malades pour lesquels une greffe allogène
de moelle osseuse est absolument indiquée et pour lesquels
ce traitement serait sûrement bénéfique est
très faible.»
Ils indiquent que pour des doses de 600 à 800 rem:
«Une greffe peut prendre, mais cette greffe aura toujours
un effet négatif en terme de thérapeutique et même
mettra la vie du malade en danger par suite d'un fort risque
de développement de maladies secondaires.»
A la suite de l'échec des greffes allogènes
de moelle, certains experts avaient proposé de constituer
une banque où l'on conserverait de la moelle osseuse appartenant
au personnel sélectionné pour intervenir en zone
très radioactive en cas d'accident afin de pouvoir procéder
à des greffes autogènes qui ont plus de chance de
succès. Il est évident que cette procédure
n'est guère possible compte tenu de ses implications psychologiques.
II. Les effets différés du rayonnement
Ce sont essentiellement l'induction de
cancers chez les irradiés et la création de défauts
génétiques chez leurs descendants.
En ce qui concerne les effets génétiques,
il y a très peu de données empiriques sûres.
Leur estimation découle la plupart du temps de la transposition
chez les humains d'observations faites sur des animaux à
reproduction rapide.
Nous n'examinerons ici que le problème
de la radioinduction des cancers:
a) Ces cancers sont absolument identiques
aux cancers «naturels». Il n'est donc pas possible
de les identifier parmi l'ensemble des cancers, de déclarer
radioinduit un cancer observé sur un individu donné
même si celui-ci a été irradié (et
inversement)
b) Pour la même irradiation, l'induction
de cancer dépendra fortement des individus, en particulier
du système immunitaire.
c) Pour un groupe assez important d'individus
irradiés, on pourra observer un accroissement de la fréquence
des cancers qui dépendra du niveau de l'irradiation.
d) L'apparition clinique de ces cancers
ne se fera qu'après un temps de latence très long,
de 2 ans pour les leucémies à plusieurs décennies
pour les autres cancers.
Ces propriétés interdisent
toute approche individuelle pour l'étude expérimentale
des effets cancérigènes du rayonnement ainsi que
pour la fixation durisque par les systèmes de radioprotection.
Seule une approche statistique a un sens mais à condition
de disposer de données de mortalité parmi une cohorte
suffisamment importante numériquement pendant une très
longue période. Dans une société nucléaire,
les statistiques de mortalité deviennent des matériaux
stratégiques qu'il est dangereux de laisser dans le domaine
public.
Lorsqu'une population a été irradiée, le
bilan de la mortalité par cancers radioinduits dans cette
cohorte ne peut se faire que de deux façons:
- soit collecter les données de
mortalité pendant plus de 30 ans et mieux jusqu'à
la disparition de la cohorte. Dans ce cas, le risque ne sera connu
qu'après la mort de ceux qui l'auront subi;
- soit évaluer les niveaux d'irradiation
et fonder le bilan sur le facteur de risque établi par
des études antérieures dont on peut garantir la
qualité. Le risque est connu avant l'extinction de la population
concernée mais l'estimation des doses reçues (ou
qui seront reçues) est difficile et source de controverse
quant aux modèles retenus pour l'effectuer, en particulier
lorsqu'il s'agit d'une irradiation par contamination interne,
par inhalation de poussières radioactives ou par ingestion
d'aliments obtenus sur des territoires contaminés.
III. Les effets de morbidité
Les experts officiels admettent généralement
qu'il n'y a pas d'effets de morbidité produits par le rayonnement,
mis à part les effets aigus aux fortes doses. En réalité,
les données de morbidité n'existent pas ou quand
elles existent, elles ne sont pas collectées avec une procédure
suffisamment rigoureuses pour être fiables. Ceci est particulièrement
vrai en France où le mépris des statistiques médicales
est cultivé avec soin. On ne possède donc pas ce
qu'on pourrait appeler un état de référence
avant irradiation qui servirait à déterminer les
anomalies de morbidité pouvant survenir dans une population
irradiée.
Il y a cependant une exception. Officiellement,
on reconnaît que le foetus est un être à haut
risque et que son irradiation peut conduire chez l'enfant à
un risque de retard mental sévère, mais aucune estimation
quantitative n'est faite pour ce risque [2].
La situation sanitaire dans les régions
contaminées d'Ukraine, de Biélorussie et de Russie
suite au désastre de Tchernobyl met en évidence
[3], sans qu'il soit nécessaire d'effectuer des études
statistiques, des anomalies très variées: augmentation
des affections pulmonaires, des cancers de la cavité buccale,
et chez les enfants affections thyroïdiennes, anémies,
cataractes, une plus grande fragilité osseuse, fatigabilité
et convalescences difficiles, etc. Pour ces populations, l'irradiation
provient essentiellement de la contamination interne. Jusqu'à
présent, on supposait qu'une contamination interne était
strictement équivalente à une irradiation externe
et des modèles mathématiques permettaient de calculer
la dose correspondant à un niveau donné de contamination.
La situation actuelle en URSS pourrait remettre ces concepts en
question, soit que certaines contaminations internes aient des
effets spécifiques, soit que les modèles mathématiques
utilisés soient faux. C'est la première fois qu'une
population aussi nombreuse est soumise à des niveaux élevés
de contamination par un véritable cocktail de radioéléments.
LE FACTEUR DE RISQUE CANCÉRIGÈNE DU RAYONNEMENT
ET LES MODÈLES REPRÉSENTATIFS
L'effet cancérigène
du rayonnement a donné lieu à une polémique
très vive parmi les spécialistes depuis près
de 20 ans. En ce qui concerne le rayonnement externe, la situation
tend à se clarifier. Les différentes études
épidémiologiques, qui semblaient totalement inconciliables
il y a quelques années, tendent actuellement à donner
des résultats très voisins.
On définit l'effet cancérigène
du rayonnement par une grandeur qu'on appelle le facteur de risque
[4]. C'est le nombre de cancers mortels qui seront induits
par unité de dose de rayonnement. Dans ce modèle,
on suppose deux propriétés:
- Toute dose produit un effet qui lui
est proportionnel. Il n'y a pas de seuil de dose en-dessous duquel
l'effet est strictement nul. Le modèle est dit linéaire.
- Les doses reçues sont cumulatives.
Ceci conduit à la notion de dose
collective: c'est la somme de toutes les doses reçues par
une collectivité pendant un temps donné.
Le facteur de risque donnera pour chaque
individu la probabilité de radioinduction d'un cancer mortel
suivant la dose individuelle qu'il aura reçue:
probabilité de cancer mortel
= facteur de risque x dose individuelle
La dose collective
permettra d'utiliser le facteur de risque pour évaluer
l'excès de cancers mortels qui apparaîtra dans une
population pour une dose collective donnée:
excès de cancers mortels = facteur
de risque x dose collective
Si l'on utilise ce
modèle linéaire, le fait de diluer les doses dans
une population plus nombreuse (en transférant des aliments
produits sur un territoire contaminé vers des régions
non contaminées) ne réduit pas le nombre total de
cancers si la dose collective est peu modifiée. Il en est
de même si la dose est répartie sur une durée
plus longue. La dilution ne modifie quasiment pas l'excès
de cancer, elle ne fait que «démocratiser»
l'effet en le diluant dans une population plus importante numériquement.
Il devient alors beaucoup plus difficile à mettre en évidence.
D'autres modèles ont été
proposés pour représenter au mieux la variation
de l'excès de cancer en fonction des doses reçues
(fig. 1):
1. Le modèle à seuil:
c'est le plus rassurant des modèles. En dessous d'une certaine
dose (généralement assez élevée),
il n'y aurait aucun effet. Dans ces conditions, la dilution pourrait
annuler l'effet si elle permet à chaque individu de recevoir
une dose inférieure au seuil.
2. Le modèle quadratique:
l'effet par unité de dose est renforcé quand les
doses augmentent. Ainsi aux faibles doses, l'excès de cancers
serait suffisamment faible pour qu'on puisse introduire la notion
de seuil pratique.
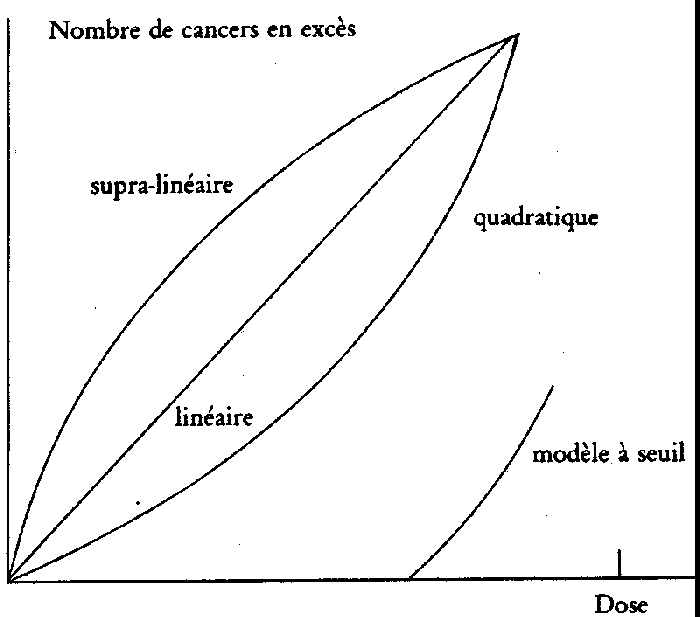
Figure 1: Différentes formes de courbes représentatives
de la relation entre le risque et le rayonnement (relation effet/dose).
3. Le modèle
linéaire: c'est celui que nous avons décrit
en détail.
4. Le modèle supra-linéaire:
l'effet par unité de dose serait renforcé quand
les doses diminuent. Dans ce cas, la dilution des doses, à
dose collective constante, conduirait à augmenter le nombre
de cancers mortels en excès. Le bénéfice
de la dilution résiderait uniquement dans l'impossibilité
pratique de mettre en évidence par étude statistique
un excès de cancers dans une très grande population.
Deux conceptions s'opposent pour définir
le risque:
a) Le risque absolu
Cette conception suppose que le nombre
de cancers en excès dans une population ne dépend
que de la dose reçue. Le facteur de risque serait identique
pour tous les individus.
b) Le risque relatif
Dans ce cas, le nombre de cancers radioinduits
dépendrait à la fois de la dose collective et de
facteurs spécifiques à la population envisagée
tels que le sexe, l'âge, l'état de santé,
le mode de vie, etc. qui, généralement, déterminent
la fréquence des cancers «naturels». Pour une
dose donnée, le facteur de risque serait d'autant plus
grand que la mortalité par cancers «naturels»
est plus élevée. Si ce modèle est accepté,
il faut définir un facteur de risque spécifique
aux divers groupes qui composent la population. La radioprotection
dans ce cas ne pourrait plus être globale et devrait tenir
compte des groupes pour lesquels le risque est le plus élevé.
La détermination du modèle
qui représente le mieux les effets cancérigènes
du rayonnement est capitale pour fonder les procédures
envisagées en radioprotection et aussi bien sûr pour
la gestion des crises nucléaires post-accidentelles.
LE SUIVI DES SURVIVANTS JAPONAIS DE HIROSHIMA ET NAGASAKI
En 1950, le gouvernement
américain décida d'effectuer un suivi de mortalité
chez les survivants des bombardements atomiques de 1945. L'étude
est faite par une fondation américano - japonaise (RERF:
Radiation Effects Research Foundation). Les résultats de
ce suivi sont périodiquement publiés. L'étude
porte sur une cohorte de plus de 90.000 personnes identifiées
par le recensement effectué en 1950 parmi les 300.000 survivants
à cette date [6].
Jusqu'à présent, cette
étude était la seule qui faisait référence
parmi les comités d'experts officiels pour l'établissement
des critères de radioprotection.
Les résultats de cette étude
ont considérablement évolué pendant les vingt
dernières années. Le schéma de la figure
2 montre comment l'estimation du risque cancérigène
du rayonnement mesuré par l'excès observé
de mortalité par cancer dépend considérablement
du moment où on arrête le bilan de mortalité.
Le bilan effectué 25 ans après l'irradiation (1970)
tient assez bien compte des leucémies radioinduites mais
présente un déficit important pour les autres cancers.
L'estimation actuelle sous-estime probablement le risque car la
totalité des cancers radioinduits en particulier chez ceux
qui ont été irradiés avant l'âge de
10 ans ne s'est pas encore exprimée.
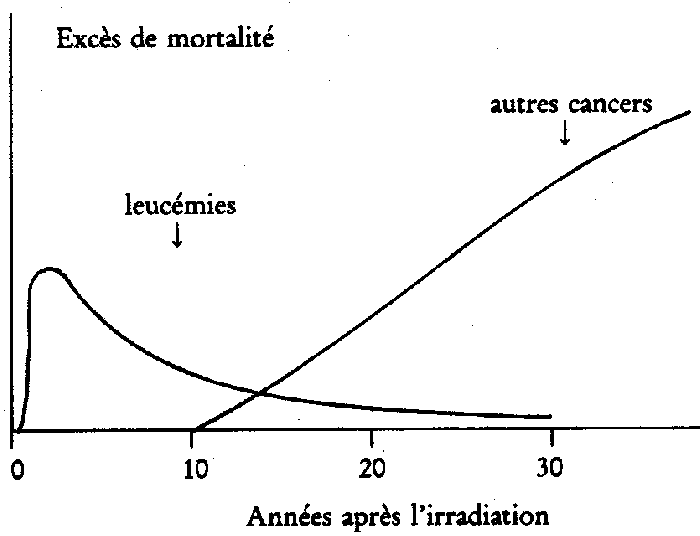
Figure 2: Schéma de l'excès de mortalité
annuelle par cancers en fonction du temps écoulé
depuis l'irradiation.
Les leucémies
apparaissent assez rapidement. On estime qu'en 1950 la moitié
de l'excès total des leucémies s'est exprimée.
Après 10 ans, la situation est redevenue quasi normale
avec cependant un léger excès.
Les tumeurs solides sont apparues après
un long temps de latence et l'excès annuel de mortalité
croit régulièrement avec le temps; il ne présente
pas de fléchissement (sauf pour la thyroïde) même
après une latence de 40 ans.
Si l'on se fie au bilan effectué
vers le début des années septante, on décompte
assez bien les leucémies mais par contre on sous-estime
considérablement les autres cancers. Les normes de radioprotection
en vigueur actuellement sont fondées sur le bilan des années
septante et les comités d'experts officiels n'ont jamais
voulu rectifier leurs estimations du risque pour les adapter aux
résultats les plus récents.
Les résultats bruts publiés
en 1987 par la fondation RERF [7,8] donnent un facteur de risque
cancérigène du rayonnement 14 fois supérieur
à celui adopté par la CIPR en 1977 soit 1.750 cancers
mortels au lieu de 125 pour une dose collective de 1 million d'hommes
x rem (1 million d'individus exposés à 1 rem ou
10.000 hommes x sievert, 10.000 personnes exposées à
100 rem ou 1 sievert).
Edward Radford, ancien président
du Comité BEIR de l'Académie des Sciences des USA,
après avoir travaillé à la fondation RERF
de Hiroshima a résumé d'une façon claire
en 1986 les conclusions de l'étude sur les survivants.
Voici les principaux points qu'il soulève:
- La mortalité par cancers ne
peut à elle seule représenter correctement le détriment
causé par le rayonnement. Il faut tenir compte également
de l'incidence des cancers non mortels. Cela multiplierait le
risque par un facteur voisin de 2.
- Le modèle du risque relatif
est celui qui représente le mieux les résultats
observés.
- Le facteur de risque dépend fortement de
l'âge à l'irradiation. En particulier, le risque
relatif des personnes irradiées avant l'âge de 10
ans est environ 8 fois plus grand que pour celles qui ont été
irradiées à l'âge de 35 ans. Il en résulte
que les enfants forment un groupe à risque élevé.
- L'hypothèse d'absence de seuil
ne surestime pas le risque (ce qu'affirmait la CIPR en 1977) [9].
La courbe représentative des excès de cancers en
fonction des niveaux de dose est compatible avec le modèle
linéaire même pour des doses assez basses. Cependant,
le modèle supra-linéaire semble le meilleur.
Ainsi, le modèle linéaire sous-estimerait le risque
dans la région des faibles doses.
- La plupart des cancers montrent un
effet du rayonnement encore en excès 40 ans après
l'irradiation.
- Certaines tumeurs bénignes sont
corrélées au rayonnement. Ce résultat montre
la possibilité d'un effet sur la morbidité, ce qui
n'avait jamais été admis officiellement jusqu'à
présent.
Les résultats sont maintenant
suffisamment clairs pour que les divers comités d'experts
officiels soient obligés de réviser leurs conceptions
sur le facteur de risque mais chacun y va de son facteur correctif
pour amortir le choc. Ces facteurs de réduction ne se fondent
pas sur des études faites sur des humains et n'ont guère
de justification. La situation actuelle concernant le facteur
de risque est résumée dans le tableau suivant:
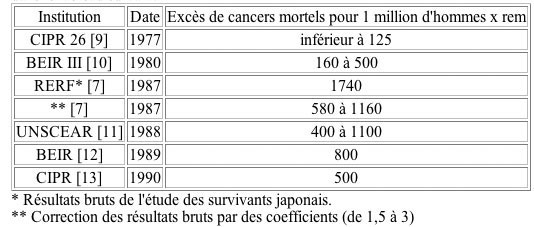
L'estimation de la CIPR (1990) correspond au
projet actuellement en discussion et non encore officiellement
adopté par la Commission.
L'estimation RERF utilise l'hypothèse
linéaire. Si on utilise le modèle supra-linéaire
de Radford, le facteur de risque aux doses faibles serait de 2700
cancers mortels pour 1 million d'hommes x rem. Ce résultat
est à comparer à celui déduit de l'étude
publiée en 1977 par Mancuso, Stewart et Kneale sur la mortalité
chez les travailleurs de l'usine nucléaire de Hanford [14].
Cette étude donnait un facteur de risque conduisant à
7400 morts par cancers pour 1 million d'homme x rem soit 2,7 fois
plus élevé que celui de Radford. Voir à ce
sujet la discussion sur le facteur de risque et la dose de doublement
dans la Gazette nucléaire n° 84/85.
Cet écart pourrait s'expliquer pour différentes
raisons:
- des erreurs inévitables dans
des études aussi complexes;
- un suivi incomplet pour les survivants
japonais, en particulier pour les enfants de moins de 10 ans en
1945;
- le fait que la population des survivants
n'est pas une population «normale» car elle a subi
une situation de catastrophe n'ayant laissé survivre que
les individus les plus robustes.
En résumé, on peut dire
que les deux grandes études épidémiologiques
sur l'effet cancérigène du rayonnement, le suivi
des survivants japonais et celui des travailleurs de Hanford dont
l'incompatibilité était flagrante en 1977, donnent
désormais des résultats assez convergents.
Les effets biologiques des rayonnements
ionisants sont certainement loin d'être totalement connus
et quantifiés quoi qu'en disent certains depuis des décennies.
Deux exemples le montrent bien:
Une enquête épidémiologique
fut ouverte en 1955 en Angleterre (Etude dite d'Oxford) pour découvrir
pourquoi l'augmentation de la leucémie avait un effet aussi
disproportionné sur les enfants de 3 ans. La cause de cet
effet fut identifiée [15,16]: l'irradiation in utero
des foetus lors des radiodiagnostics pratiqués sur les
femmes enceintes. Ce résultat inattendu bouleversait les
conceptions admises alors au sujet des effets biologiques du rayonnement.
Au lieu de s'interroger pour élargir le champ de l'étude,
les officiels de la santé rejetèrent les résultats,
l'étude était officiellement déclarée
fausse a priori. Il fallut attendre des dizaines d'années
pour admettre que les foetus sont des êtres particulièrement
sensibles au rayonnement et qu'il faut éviter d'irradier
l'abdomen des femmes enceintes. Pendant toute cette période,
on a continue à irradier des foetus.
Plus récemment, une étude
de Martin J. Gardner publiée dans le British Medical
Journal[17] sur l'excès de leucémies chez les
enfants dans la région voisine de l'usine nucléaire
anglaise de Sellafield mettait en évidence un effet nouveau
et tout à fait inattendu du rayonnement. L'excès
de leucémies pouvait être attribué à
l'irradiation professionnelle des pères ayant travaillé
à l'usine. La corrélation est très forte
pour ceux qui ont été irradiés dans les 6
mois qui précédèrent la conception. Il pourrait
s'agir d'une action mutagène du rayonnement sur le sperme.
Ceci bien sûr bouleverse une fois de plus les conceptions
officielles de la radioprotection. Mais reconnaître ce fait
nouveau devrait conduire à la réduction des doses
maximales admissibles pour les travailleurs exposés aux
rayonnements et le développement de l'industrie nucléaire
risquerait d'être compromis.
La situation actuelle dans les zones
contaminées d'Ukraine, de Biélorussie et de Russie,
suite à la catastrophe de Tchernobyl, montre que les problèmes
liés à la contamination interne sont loin d'être
élucidés et en tout cas se révèlent
plus importants du point de vue des conséquences sanitaires
que ce qui était admis jusqu'à présent.
Au cours du temps, toutes les études
ont finalement montré que l'être humain a une très
grande sensibilité au rayonnement alors que les promoteurs
de l'industrie nucléaire (que ce soient les savants, les
techniciens ou les industries) admettaient a priori l'inocuité
du rayonnement aux doses faibles.
Alice Stewart a parfaitement résumé
l'importance du rayonnement sur les êtres vivants [6]:
«Bien que nous ne sachions pas quand
commença la vie sur cette planète, nous avons appris
que même les formes les plus primitives de vie ne sont pas
compatibles avec de forts niveaux de radioactivité. Par
conséquent, il est possible que la vie, et le développement
de la biosphère à la surface de la terre, durent
attendre que l'intensité de la radioactivité à
la surface du sol ait décru jusqu'aux niveaux actuels.
La découverte des rayons X, puis celle du radium, rendirent
possible la surexposition individuelle des animaux ou des plantes,
à des niveaux de rayonnement accrus, dans les pays à
technologie avancée. Ce ne fut qu'après la découverte
de la fission nucléaire qu'il y eut accroissement de certains
niveaux de rayonnement ambiant. Ainsi, le problème actuel,
héritage direct de la 2ème guerre mondiale, est
d'empêcher qu'un processus inverse du processus naturel
puisse causer d'irréparables dommages aux forces de vie.»
Roger Belbéoch,
"La Radioactivité et le vivant" dossier publié
par Stratégies énergétiques, Biosphère
& Société (SEBES),
Forum interdisciplinaire indépendant,
Genève, novembre 1990.
SIGLES UTILISÉS:
CIPR Commission Internationale de Protection Radiologique.
BEIR Biological Effects of Ionizing Radiation. Comité
de l'Académie des Sciences des USA pour l'étude
des effets biologiques des rayonnements ionisants. (Lire les commentaires
et intervenants
à la BEIR Conference de Londres 24-25 novembre 1986)
UNSCEAR United Nations Committee on the Effects of Atomic
Radiation, Comité des Nations Unies pour l'étude
des effets des radiations.
RERF Radiations Effects Research Foundation, Comité
mixte américano-japonais pour l'étude du suivi des
survivants japonais des bombres.
GSIEN Groupement de Scientifiques pour l'Information sur
l'Energie Nucléaire, 2, rue François-Villon, F-91400
Orsay.
RÉFÉRENCES BIBLIOGRAPHIQUES:
1. The accident at Chernolyl Nuclear Power Plant and its
consequences. Information compiled for the IAEA Experts Meeting,
25-28 august 1986, Vienna. USSR State Committee on the Utilization
of Atomic Energy. Annex 7, Medical-Biological Problems.
2. Statement
from the 1987 Como Meeting (Italy) of the International Commission
on Radiological Protection, ICRP/87/G-05, 1986-10-09.
3. Dossier sur Tchernobyl, La Gazette Nucléaire,
n° 96/97 (juillet 1989) et n° 100 (mars 1990),
édité par le GSIEN, 2, rue François-Villon,
F-91400 Orsay.
4. BELBÉOCH, Roger, Effets biologiques à long terme des faibtes
doses de rayonnement ionisant, Actes du Colloque de Montauban,
Nucléaire-Santé-Sécurité, 21-23 janvier
1988, édition par le Conseil général de Tarn-et-Garonne,
France.
5. BELBÉOCH, Roger (1988), Les effets biologiques
des faibles doses de rayonnement. Introduction in Santé et Rayonnement, Effets cancérigènes
du rayonnement, édité par GSIEN / CRII-RAD.
6. STEWART, Alice (1983), «Effets sur la santé
de l'irradiation par des doses faibles», La Gazette nucléaire,
n° 56/57, décembre; pour sa numérisation,
voir la Rétrospective.
7. PRESTON, Dale and Donald A. PRESTON (1987), The effects
of change in dosimetry on cancer mortality risks estimates in
the Atom Bomb Survivors, Technical Report RERF, 9-87, august.
8. RADFORD, Edward (1987), «Recent evidence of radiation induced cancer in
the Japanese atomic bomb survivors», in Radiation
and Health, Wiley Medical Publication. Partiellement dans
la Gazette nucléaire, n° 84/85, janvier
1988.
9. Annals of the ICRP, Publication
26 - Recommendations of the International Commission on Radiological
Protection, janvier 17-1977.
10. BEIR III report (1980), The effects on population of
exposure to low levels of ionizing radiation. Report of the
Committee on the Biological Effects of Ionizing Radiation, National
Research Council, Washington DC.
11. SOURCES, Effects and Risks of Ionizing Radiation,
United Nations Scientifîc Committee on the Effect of Atomic
Radiation (UNSCEAR), 1988, Report to the General Assembly United
Nations, New York, 1988.
12. Health Effects of Exposure to Low Levels of Ionizing
Radiation, Report V of the BEIR Committee, National Academy
of Presi, Washington DC, 1990.
13. International Commission on Radiological Protection,
Recommendations of the Commission ICRP/90/G-01, Feb. 1990.
14. MANCUSO, Thomas F., Alice STEWART and George KNEALE (1977),
«Radiation
Exposures of Hanford Workers dying from Cancer and Other Causes»,
Health Physics, vol. 33, n° 5, p. 369-385. G.W.
KNEALE, T.F., Alice M. MANCUSO and M. STEWART, Hanford radiation
study III: a cohort of the cancer risks from radiation to workers
at Hanford (1944:77 deaths) by the method of regression models
in life-tables. - R.
BELBÉOCH, B. BELBÉOCH et D. LALANNE (1978), «Effets
des faibles doses de rayonnement», Fiche Technique, n°
34, GSIEN, février 1978.
15. STEWART, A.M. and G.W. KNEALE (1970), «The age distribution
of cancers caused by obstetric X-rays and their relevance to cancer
latent periods», Lancet, i: 1185.
16. KNEALE, G.W. and A.M. STEWART (1976), «Mantel-Haenszel Analysis of Oxford data»,J.
Nat. Cancer Inst., vol. 56, n° 5, p. 879-883, vol. 47, p.
1009.1014.
17. GARDNER, Martin J.et al. (1990), «Results
of case-control study of leukaemia and lymphoma among young people
near Sellafield nuclear plant in West Cumbria», British
Medical Journal, vol. 300, feb. 17.


